प्रकृति में पाये जाने वाला हर तत्व बहुत से परमाणुओं से मिलकर बनता है। परमाणु के केंद्र में एक नाभिक होता है, जिसमें प्रोटोन एवं न्यूट्रॉन पाए जाते है तथा नाभिक के चारों ओर इलेक्ट्रॉन चक्कर लगाते रहते है। प्रोटोन, इलेक्ट्रॉन तथा न्यूट्रॉन के भौतिक गुणों (भार, आवेश, चक्रण आदि) में अंतर पाया जाता है, जिसके आधार पर इन्हें विभिन्न क्षेत्रों में अलग-अलग तरह से प्रयोग किया जाता है। जब ये हमारे शरीर के संपर्क में आते है तो शरीर की कोशिकाएं इनमें प्रभावित होने लगती है।
आवेशित ऊर्जावान इलेक्ट्रॉन (-1) एवं प्रोटोन (+1) तथा आवेशहीन गामा किरणें/एक्स -रे फोटोन अपने संपर्क में आने वाले पदार्थों के परमाणुओं का ऋणात्मक आयन बनाते है। दूसरी ओर, आवेशहीन न्यूट्रॉन अपने संपर्क में आने वाले पदार्थ के परमाणुओं से प्रत्यक्ष क्रिया नहीं करते है तथा वे वातापरण में लंबी दूरी तक जा सकते है।
न्यूट्रॉन अपने संपर्क में आए परमाणुओं से (न्यूट्रॉन, गामा), (न्यूट्रॉन, प्रोटोन), (न्यूट्रॉन, अल्फा) उत्पन्न करने के साथ-साथ कोशिका में मौजूद तत्वों को दूसरे तत्वों में परिवर्तित करके कोशिका की मूल संरचना को हानि पहुंचाते है। कैंसर के उपचार में गामा/एक्स किरणों को ‘टेलीथेरैपी / ब्रेकीथेरैपी’ में, इलेक्ट्रॉन कण पुंज को ‘इलेक्ट्रॉन बीम थेरैपी’ में, न्यूट्रॉनों को ‘न्यूट्रॉन बीम थेरैपी’ एवं ‘बोरोन न्यूट्रॉन कैप्चर थेरैपी’ में तथा प्रोटोन कण पुंजों को टेलीथेरैपी विधि के माध्यम से प्रयोग मे लाया।
विकिरण के प्रत्यक्ष एवं अप्रत्यक्ष प्रभाव : आयनकारी विकिरण प्रत्यक्ष अथवा अप्रत्यक्ष प्रभाव से अपने संपर्क मे आने वाले पदार्थों को प्रभावित करते हैं। प्रत्यक्ष प्रभाव में विकिरण के संपर्क में आने वाले परमाणुओं के आयनन द्वारा ऊर्जावान कण (जैसे-इलेक्ट्रॉन आदि) उत्पन्न होते है, जो प्रायः कोशिका पर प्रहार करके उसमें डीएनए की रस्सी में मौजूद अणुओं के रासायनिक बंधों को तोड़कर क्षतिग्रस्त कर देते है। अप्रत्यक्ष प्रभाव में प्रायः विकिरण की ऊर्जा से कोशिकीय परिवेश में मौजूद पानी के अणुओं के विकिरणीय अपघटन द्वारा भ्ए व्भ् आदि जैसे क्रियाशील मुक्त मूलकों का निर्माण होता है। ये मुक्त मूलक कोशिकीय अणुओं जैसे – डीएनए, लिपिड्स तथा उप-कोशिकीय घटकों आदि को नुकसान पहुंचाते है।
विकिरण के उद्भासन द्वारा ऐसी क्षति होने से कोशिका पुनरुत्पादन एवं प्रसरण की प्रक्रिया रुक जाती हैं। फोटोन थेरैपी (गामा किरण या एक्स-रे थेरैपी) में कोशिकाओं पर विकिरण का अधिकांश प्रभाव मुक्त मूलकों के माध्यम से ही होता है। कोशिकाओं में डीएनए के सिंगल स्ट्रैंड क्षति की तुलना में डबल स्टैं्रडेड डीएनए ब्रेक की मरम्मत ज्यादा कठिन होती है। तथा वे गुणसूत्र असमानताओं और आनुवांशिक विलोपन का करण बन सकेते है।
डीएनए की दोनों रस्सियों के विखंडन को लक्षित करने से कोशिका मृत्यु की संभावना बढ़ जाती है। विकिरण के प्रहार को अप्रभावी बनाने के लिए कोशिकाओं में सिंगल स्टैं्रड डीएनए क्षति और डबल स्टैं्रड डीएनए क्षति के सुधारतंत्र मौजूद होते हैं, जो कि विकिरण के घातक प्रभाव को कुछ हद तक रोके जाने का प्रयास करते है। परंतु विकिरण की सही मात्रा की डोज देने पर इन सुधारतंत्रों का वश नहीं चलता है। तथा ट्यूमर कोशिकाएं धीरे-धीरे नष्ट होने लगती है। विकिरण डोज देने के बाद अनेक कारणों / मार्गों से कोशिकामृत्यु हो सकती है। परंतु, ‘विकिरण प्रेरित कोशिका मृत्यु’ अथवा ‘सेनिसेंस’ प्रक्रियाओं को कोशिका हनन का प्रमुख कारण माना जाता है।
कैंसरग्रस्त कोशिकाओं के गुण : हमारा शरीर अलग-अलग तरह की कोशिकाओं से मिलकर बना होता है। कोशिकाएं आपस में मिलकर ऊतकों का निर्माण करती हैं और ऊतकों का समूह अंगों का निर्माण करता है। शरीर के विभिन्न अंग अनेको संकेत प्रणालियों के माध्यम से आपस में संवाद और सहयोग करते हुए हमें स्वस्थ बनाए रखते है। अंगों के सुचारू रुप से काम करते रहने के लिए पुरानी कोशिकाएं एक निर्धारित समय के बाद नष्ट होती रहती है और उनकी जगह नयी कोशिकाओं का निर्माण होता रहता है।
पुरानी कोशिका से नयी कोशिकाओ ंको बनाने में कोशिका में पाए जाने वाले डीएनए की मुख्य भूमिका होती है। कोशिका विभाजन की प्रक्रिया को ‘माइटोसिस’ तथा कोशिका संश्लेषण और विभाजन के विभिन्न चरणों के क्रम को ‘कोशिका चक्र’ के नाम से जाना जाता हैं। सामानय कोशिकाएं बहुत ही अनुशासित, सुनिश्चित आकार की तथा नियंत्रित होती है तथा वे शरीर के विभिन्न प्रणालियों से आने वाले संकेतों का पूरी निष्ठा से पालन करती हैं। इसी कारण विभिन्न अंगों का कोशिकाचक्र भी नियंत्रित रहता है और किसी अंग में कोशिकाओं की अनियंत्रित वृद्धि नहीं हो पाती हैं।
जब किसी आनुवांशिक कारण से या किसी बाहरी दुष्प्रभाव से शरीर की संकेत-संप्रेषण की प्रक्रियाएं बाधित होने लगती हैं तो कुछ कोशिकाएं अनुशासनहीन होकर विभिन्न स्त्रोंतों से आने वाले संकेतों को नजरअंदाज करके कैंसर (कोशिकाओं की असामानय एवं अनियंत्रित वृद्धि) को जन्म देने लगती है।
यदि शरीर की प्रतिरक्षा प्रणाली इस प्रकार आयी अनियमितताओं में समय रहते सुधार नहीं कर पाती है तो प्रभावित अंग की कोशिकाओं की अनियंत्रित और असामानय वृद्धि होने लगती है। इस दशा में पुरानी कोशिकाओं की मृत्यु भी नहीं होती है और वे तेजी से विभाजित होकर आधार झिल्ली से बाहर निकलकर अन्य अंगों तक फैलने का प्रयास करने लगती है।
कैंसर की कोशिकाएं आम तौर पर कम विभेदित होती हैं और वे प्रायः स्टेम कोशिकाओं जैसी ही होती है। कैंसरग्रस्त कोशिकाओं के आवपास के परिवेश की अम्लता बढ़ने लगती है तथा कोशिका के अंतरस्थलीय द्रव का दबाव बढ़ जाता है। कैंसरग्रस्त कोशिकाओं के आकार में सुनिश्चितता नहीं रहती तथा कैंसरीय परिवेश में ऑक्सीजन का दबाव कम होने लगता है।
ऊर्जा पाने के लिए वे मुख्यतः ग्लूकोस पर ही निर्भर रहती हैं तेजी से बढ़ती हुई आबादी के पोषण हेतु रक्त की आपूर्ति के लिए वे नयी रक्तवाहिकाओं का निर्माण भी करने लगती हैं, जिसे ‘वाहिका जनन’ नाम से जाना जाता है।
हमारे शरीर में इस प्रकार की रक्षा प्रणालियां मौजूद होती हैं जो कोशिकाओं की अनियंत्रित और असामान्य वृद्धि पर रोक लगाए रहती हैं और कैंसर जैसे रोग को पनपने नहीं देती है। परंतु जब दुर्भाग्यवश बहुत सारे सुधार मार्ग काम नहीं कर पाते है तभी कैंसर जैसी दुर्दम्य बीमारी का जन्म होता है। एक सीमा से अधिक कोशिकावृद्धि होने पर कैंसरग्रस्त कोशिकाएं किसी आंतकवादी की तरह भयंकर रूप लेकर शरीर के अन्य अंगों में फैलकर अपनी कॉलोनी बनाने लगती है। इसे रोगव्याप्ति नाम से जाना जाता है। ऐसी स्थिति में कैंसर का इलाज करना बेहद कठिन हो जाता है।
कैंसर कोशिकाएं स्वस्थ विभेदित कोशिकाओं से अधिक पुनरुत्पादन करती है। इसके अतिरिक्त उनमें विकिरण प्रेरित उप-घातक क्षति की मरम्मत करने की क्षमता स्वस्थ कोशिकाओं की तुलना में कम होती है। विकिरण चिकित्सा में इसी सिद्धांत का लाभ उठाकर ट्यूमर को अधिक से अधिक तथा स्वस्थ कोशिकाओं को कम से कम नुकसान पहुंचाया जाता हैं।
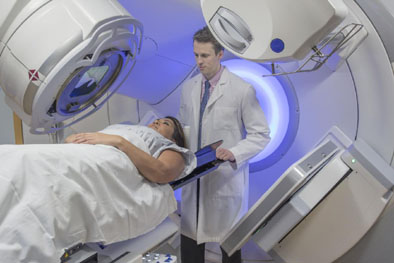
कैंसर के उपचार में विकिरण चिकित्सा का स्थान : कैंसर की प्रकृति और उसके फैलाव के आधार पर कैंसरग्रस्त भाग के उपचार में शल्यक्रिया, रसोचिकित्सा, फोटोडाइनामिक थेरेपी, विकिरण चिकित्सा आदि का प्रयोग किया जाता है। लगभग 40 प्रतिशत से भी अधिक रोगियों के इलाज में रोग की किसी न किसी अवस्था में विकिरण चिकित्सा या तो रोग का नाश करने या अत्यधिक फैले हुए कैंसर से होने वाले दर्द का शमन करने के काम आती है। आम भाषा में इसे कैंसर के इलाज के लिए की जाने वाली ‘सिकाई’ के नाम से जाना जाता हैं।
विकिरण चिकित्सा में त्वरक में उत्पादित फोटोन / इलेक्ट्रॉन पुंज अथवा विभिन्न रेडियोआइसोटोप्स से निकलने वाले अल्फा या बीटा कणों, इलेक्ट्रॉनों या एक्स-रे / गामा किरणों को कैंसरग्रस्त भाग पर फोकस किया जाता है। विकिरण चिकित्सा में दूर चिकित्सा (टेलीथैरेपी) अथवा निकट चिकित्सा तकनीकों के माध्यम से विकिरण डोज दी जाती है।
दूर चिकित्सा में सरल रैखिक त्वरण से निर्मित इलेक्ट्रॉन पुंज अथवा एक्स-रे फोटोनों के अतिरिक्त उच्च वाली गामा किरणें उत्सर्जित करने वाले कोबाल्ट-60 या इरिडियम-192 आदि से बने सीलबंद स्रोत प्रयोग किये जाते है। जहां विकिरण डोज को ट्यूमर में बहुत कम दूरी तक ही (कुछ, मिलीमीटर तक) जमा करना होता है, वहां निकट चिकित्सा विधि द्वारा अपेक्षाकृत कम ऊर्जा की गामा किरणे या उच्च ऊर्जा के बीटा कण उत्सर्जी रेडियोआइसोटोप्स (जैसे-आयोडीन-125, पैलेडियम-103, स्ट्रॉशियम / इट्रियम-90 आदि) से निर्मित स्रोत प्रयोग में लाये जाते है।
बहुत कम दूरी में ही अपनी पूरी ऊर्जा का जमाव कर सकने के गुण के कारण अल्फा कणों से बने उत्पादों को वैज्ञानिक समुदाय द्वारा भविष्य की विकिरण चिकित्सा के रुप में बहुत आशाभारी नजरों से देखा जा रहा है। परंतु अल्फा कण उत्सर्जी स्रोतों की उपलब्धता बहुत कम है, जिस कारण उन्हें बहुत कम जगह प्रयोग में लाया जा रहा है।
विकिरण चिकित्सा की सभी विधियों में इस बात का प्रयास किया जाता है कि कैंसरग्रस्त भाग को अधिकतम डोज मिले और आसपास की स्वस्थ कोशिकाओं को कम से कम विकिरण डोज प्राप्त हो। ऐसा न होने पर स्वस्थ कोशिकाओं में आगे जाकर कई तरह के विकार अथवा द्वितीयक कैंसर पैदा होने की संभावना प्रबल हो जाती है।
विकिरण की डोज दिये जाने के पश्चात् स्वस्थ कोशिकाएं जल्दी ही अपने विकारों को सुधारने में समर्थ होती हैं तथा कैंसरग्रस्त कोशिकाओं की सुधार क्षमता कम होने के कारण ट्यूमर धीरे-धीरे सिकुडने लगता है। चिकित्सीय दल ट्यूमर के प्रकार और अन्य महत्वपूर्ण तथ्यों को ध्यान में रखते हुए विकिरण डोज की मात्रा का निर्धारण करता हैं। रेडिएशन डोज का मात्रक ‘ग्रे : Gy’ होता है। पदार्थ के एक किलोग्राम वनज में यदि विकिरण द्वारा 1 जूल ऊर्जा का जमाव किया जाता है तो उसे विकिरण की 1 Gy (ग्रे) मात्रा की अवशोषित डोज के बराबर माना जाता है।
कैंसर के उपचार में दूर-चिकित्सा तकनीक के क्षेत्र में प्रोटोन कण पुंज के प्रयोग पर विश्व भर में बहुत तेजी से शोध-कार्य किया जा रहा है। प्रोटोन चिकित्सा प्रणालियों को अपने देश में स्थापित करने के लिए सिर्फ विश्व के धनी देश ही नहीं बल्कि विकासशील देश भी काफी उत्साह का प्रदर्शन कर रहें है।
कण त्वरकों द्वारा प्रोटोन कण पुंज का निर्माण : प्रोटोन कण पुंज उत्पन्न करने के लिए एक प्रोटोन स्रोत की आवश्यकता होती है, जिसे उपचार के लिए पर्याप्त ऊर्जा हासिल करने तक मशीनों द्वारा त्वरित किया जा सकता है। इसके लिए हाइड्रोजन का उपयोग किया जाता है। हाइड्रोजन के परमाणु बीम तैयार करने के लिए ‘साइक्लोट्रॉन’ एवं ‘सिंक्रोट्रॉन’ नामक दो सबसे अधिक इस्तेमाल किए जाने वाली मशीनों का प्रयोग किया जाता है। इसके अलावा अतिचालक या सुपरकंडक्टिंग साइक्लोट्रॉन भी प्रयोग में लाये जाते है। सुपरकंडक्टिंग साइक्लोट्रॉन गैर-सूपरकंडक्टिंग मशीनों की तुलना में छोटे होने और भारी न होने के कारण अधिक फायदेमंद होते है। साइक्लोट्रॉन में विशेष चुंबकों की मदद से इस प्रकार चुंबकीय क्षेत्र लगाया जाता है जो प्रोटोन को एक सर्पिल मार्ग पर चलाने में सहायक सिद्ध होता हैं।
चुंबकीय क्षेत्र और वोल्टता में हमेशा एक समान अंतर रखा जाता है और प्रोटोन वृत्तीय पथ में ऊर्जा हासिल करते हुए धीरे-धीरे एक निश्चित ऊर्जा प्राप्त करने तक आगे बढ़ते रहते है। जिसके बाद उन्हें बाहर निकाला जाता है। चुंबकीय क्षेत्रों की सामर्थ्य साइक्लोट्रॉन से कण को प्राप्त होने वाली ऊर्जा का मान निर्धारित करती हैं। साइक्लोट्रॉन से एक निश्चित ऊर्जा की सतत प्रोटोन कण पुंज का उत्पादन किया जा सकता है। प्रयोगकर्ता की आवश्यकतानुसार साइक्लोट्रॉन से प्राप्त होने वाली प्रोटोन बीम की ऊर्जा के मान को बदला भी जा सकता हैं। सिंक्रोटॉन मशीनों के कण को एक निश्चित त्रिज्या के वृत्त में घुमाकर त्वरित किया जाता है। जिसके लिए कण द्वारा प्रत्येक चक्कर लगाने के पश्चात चुंबकीय क्षेत्र की तीव्रता को भी यथानुसार बदलते रहना पड़ता है।
कणों की ऊर्जा तथा चुंबकीय क्षेत्र की तीव्रता में निरंतर सामंजस्य बनाए रखने के कारण ही इन्हें ‘सिंक्रोट्रॉन’ नाम से जाना जाता है। इन मशीनों में कण के सिंक्रोट्रॉन की रिंग में प्रवेश करने के पहले उसे आरंभिक ऊर्जा प्रदान की जाती है। जिसके लिए प्रायः एक सरल रैखिक त्वरक का प्रयोग किया जाता है।
सिंक्रोट्रॉन द्वारा आवश्यकतानुसार अलग-अलग ऊर्जाओं की एवं स्पंदित प्रोटोन बीम तैयार की जा सकती है। साइक्लोट्रॉन या सिंक्रोट्रॉन दोनों ही प्रकार की मशीनों से प्रोटोन बीम को चिकित्सा कक्ष तक पहुंचाने के लिए अत्याधुनिक बेंडिंग, स्टीयरिंग तथा फोकसिंग प्रणालियों का प्रयोग किया जाता है। प्रोटोन बीम को अलग-अलग दिशाओं से कैंसर से प्रभावित अंग तक पहुंचाया जाता है, जिसके लिए विशेष ‘गैंट्रियां’ प्रयोग में लायी जाती है।
प्रोटोन चिकित्सा का विकास : प्रोटोन थेरेपी के लिए इस्तेमाल होने वाले सबसे पहले साइक्लोट्रॉन की डिजाइन को सर्वप्रथम भौतिकीय अनुसंधान कार्य के लिए बनाया गया था, जिसे बाद में उपचार सुविधाओं के रुप में बदल दिया गय था।
1946 के बाद से ही वैज्ञानिक समुदाय द्वारा प्रोटोन चिकित्सा के महत्व को समझ लिया गया था और तब से लेकर अब तक इस दिशा में निरंतर प्रगति होती रही है। वर्ष 1989 में यूनाइटेड किंगडम के ‘क्लैटरब्रिज सेंटर ऑफ ऑनकोलोजी’ ने एक कम ऊर्जा वाली प्रोटोन बीम तैयार किये जाने वाले साइक्लोट्रॉन को नेत्र कैंसर के मरीजों के इलाज हेतु समर्पित किय था। इसी कारण इस केंद्र को विश्व का सर्वप्रथम चिकित्सालय-स्थित प्रोटोन थेरेपी केन्द्र होने का गौरव प्राप्त है।
वर्ष 1990 में लोमा लिंडा, कैलीफोर्निया में ‘लोमा लिंडा यूनिवर्सिटी मेडिकल सेंटर ने एक समर्पित ‘प्रोटोन चिकित्सा प्रणाली’ की स्थापना करके एक नये युग की शुरूआत की थी। तत्पश्चात्, विश्व के कई स्थानों पर प्रोटोन चिकित्सा इकाईयां स्थापित की गई है। वर्ष 2017 के आंकडों के अनुसार इस समय विश्व में लगभग 75 के आसपास प्रोटोन चिकित्सा इकाईयां कार्यरत हैं तथा 40 से अधिक प्रणालियां निर्माणाधीन है।
प्रोटोन बीम की ऊर्जा तथा बीम का ऊतक की अधिकतम गहराई तक पहुंचने के बीच सीधे संबंध होता है। कम ऊर्जा की प्रोटोन बीम को केवल सतही ट्यूमर के इलाज के लिए उपयोग किया जा सकता है। उदाहरण के लिए प्रोटोन थेरैपी हेतु वर्तमान में उपयोग किए जाने वाले कई साइक्लोट्रॉनों में 70 Me Vकी ऊर्जा सीमा होती है, जो लेवल आंख के ट्यूमर के इलाज के लिए उपयुक्त होती है। कभी-कभी बीम को फैलाकर 30-30 cm2 तक के बड़े क्षेत्र में भी प्रयोग किया जाता है। जिसके कारण वह ऊतक की कम गहराई तक ही प्रवेश कर पाती है। मानव शरीर में होने वाले सभी सामान्य ट्यूमरों का इलाज करने में सक्षम होने के लिए, साइक्लोट्रॉन को लगभग 230 से 250 Me V तक की ऊर्जा की ऐसी बीम प्रदान करने में सक्षम होना चाहिए, जो ऊतक में लगभग 20 से 32 सेमी. की गहराई तक जा सकें। लगभग 2 Gy /min (ग्रे प्रति मिनट) की चिकित्सीय विकिरण डोज प्रदान करने हेतु बीम की तीव्रता कुछ सौ नैनो एम्पियर (nA) से लेकर मिली एम्पियर (mA) के स्तर तक की होती है। कैंसर की प्रकृति और उसके आकार के आधार पर चिकित्सकों का दल प्रोटोन बीम की ऊर्जा और किरणन अवधि का निर्धारण करता है।
प्रोटोन चिकित्सा के लाभ : विकिरण थेरैपी में परंपरागत रूप से प्रयोग किये जाने वाले फोटोन (गामा / एक्स किरण) से मिलने वाली डोज के वितरण में बहुत सारी विशेषताएं होती है। उच्च रैखिक हस्तांतरण होने के कारण प्रोटोन कण कैंसरग्रस्त कोशिका के डीएनए को सीधे नुकसान पहुंचा सकते है। आमतौर पर ये कण प्रत्यक्ष ऊर्जा हस्तांतरण के माध्यम से कार्य करते है। अतः उनका प्रहार कोशिका के डबल स्ट्रैंड डीएनए ब्रेक का कारण बनता है। इलेक्ट्रॉन की तुलना में अधिक द्रव्यमान का होने के कारण ऊतक में प्रोटोन कणों का बिखराव भी कम होता है जिससे इनकी बीम बहुत अधिक न फैलते हुए ट्यूमर की आकृति पर ही केंद्रित रहती है। इस कारण ट्यूमर के आसपास के स्वस्थ ऊतकों को विकिरण की अनावश्यक डोज नहीं मिलती है।
जब पारंपरिक विकिरण (फोटोन) से चिकित्सा की जाती है तो विकिरण के शरीर में प्रवेश करने की शुरूआत में विकिरण के संपर्क में आने वाले शरीर के अंगों के एक छोटे से क्षेत्र में ऊर्जा का जमाव बढ़ता है। उसके बाद विकिरण की ऊतक में बढ़ती गहराई के साथ-साथ ऊर्जा की जमावट तेजी से घटती हुई दिखाई देती है। इसके विपरीत, प्रोटोन बीम के शरीर में प्रवेश करने पर जैसे -जैसे ऊतक मे उसके प्रवेश की गहराई बढती जाती है, वैसे-वैसे कण द्वारा हस्तांतरित की गई ऊर्जा की जमावट भी बढ़ती जाती है। कण के रास्ते के अंतिम चरण में अधिकतम ऊर्जा का स्थांतरण होता है, जिसे ‘ब्रैग पीक’’ के नाम से जाना जाता है। ऊतक के माध्यम से गुजरने वाले प्रोटोन अपने रास्ते में आने वाले परमाणुओं / नाभिकों से क्रिया करते हैं, जिससे प्रोटोन की ऊर्जा कम हो जाती है, जिसके कारण उनकी विभिन्न कक्षाओं में घूमते हुए इलेक्ट्रॉन के साथ क्रियाकरने की संभावना बढ़ जाती है।
धीमें हो चुके प्रोटोन तथा इलेक्ट्रॉनों की परस्पर क्रिया प्रोटोन बीम के पथ की सीमा के अंत में सबसे अधिक होती है, जिससे लक्षित क्षेत्र में अधिकतम ऊर्जा हस्तांतरित होती है। परंपरागत विकिरण की तुलना में प्रोटोन की यह भौतिक विशेषता ही प्रोटोन चिकित्सा में लाभप्रद सिद्ध होती है, क्योंकि इसके द्वारा किसी निश्चित दिशा में आने वाली बीम के लिए लक्ष्य के भीतर अधिकतम ऊर्जा जमावट का क्षेत्र निर्धारित किया जा सकता है।
यदि बहुत की अलग-अलग ऊर्जा वाली बीम लाइनों को ट्यूमर क्षेत्र में केंद्रित किया जा सके तो ‘बैग पीक’’ का विस्तार हो जाता है, जिसे ‘विस्तारित बैग पीक’’ (स्प्रैड आउट बैग पीक) कहा जाता है। ठव्ैच् व्यवस्था एक उच्च अनुरूपता वाली विकिरण डोज का क्षेत्र बनाती है, जिससे पूरे ट्यूमर वॉल्यूम को उच्च सटीकता से कवर करने की संभावना भी बढ़ जाती है। प्रोटोन बीम थेरैपी परंपरागत फोटोन या इलेक्ट्रॉन विकिरण चिकित्सा तकनीकों की तुलना में स्वस्थ ऊतक को विकिरण की कम डोज प्रदान करती है। प्रोटोन बीम के चिकित्सालयीन उपयोग के लिए दिए जाने वाला सबसे महत्वपूर्ण तर्क ट्यूमर को उच्च डोज देने की व्यवहार्यता है, जिससे ट्यूमर नियंत्रण संभावना में वृद्धि होती है। अन्य अत्यधिक अनुरूपी चिकित्सा की तकनीकों की तरह प्रोटोन थेरैपी ऐसे ट्यूमरों के लिए विशेष लाभप्रद है, जो श्रेणीबद्ध ऊतको के नजदीक स्थित होते हैं तथा जहां एक छोटा स्थानीय ओवरडोज भी घातक जटिलता का कारण बन सकता है (जैसे- रीढ की हड्डी के करीब अधिकांश ट्यूमर, महत्वपूर्ण संरचनाओं के पास अनियमित आकार के ट्यूमर आदि।)
महत्वपूर्ण अंगों के पास के अनिश्चित आकार के ट्यूमर प्रोटोन थेरैपी देने के अनुकूल होते है। प्रोटोन थेरैपी विभिन्न अंगों के उपचार में प्रयोग की गयी है, जिसमें परानाल साइनस ट्यूमर, कॉर्डोमा, कोंड्रोसार्कोमा, मेनिंगिओमा, प्रोस्टेट और फेफड़े का ट्यूमर, सिर और गले के क्षेत्रों के ट्यूमर आदि शामिल है। चिकित्सीय परिणामों में यह पाया गया है कि परंपरागत फोटोन तकनीकों तथा तीव्रता मॉड्यूटेड फोटोन चिकित्सा योजनाओं की तुलना में प्रोटोन थेरैपी द्वारा स्वस्थ कोशिकाओं को काफी कम डोज देकर भी ट्यूमर को आवश्यक चिकित्सीय डोज दी जा सकती है। इसे ‘डोज एस्केलेशन’ नाम से जाना जाता है।
ट्यूमर को डोज देने के पश्चात् बची कम ऊर्जा की प्रोटोन बीम के ट्यूमर से बाहर निकलते समय टयूमर से अप्रभावित क्षेत्र को बहुत कम विकिरण डोज मिलती है, जिससे स्वस्थ अंगों पर विकिरण डोज के विपरीत प्रभाव होने की संभावना न के बराबर होती है। प्रोटोन बीम से शरीर के महत्वपूर्ण अंगों की स्वस्थ कोशिकाओं को मिलने वाली डोज में कमी होने के कारण बाल रोगियों के इलाज के लिए यह तकनीक बहुत अधिक लाभप्रद मानी जाती है। बाल रोगियों के नेत्र कैंसर रेटिनोब्लास्टोमा में इस तकनीक का प्रभावी प्रयोग किया जा चुका है। इसके अतिरिक्त मस्तिष्क के कैंसर ‘ग्लिओब्लास्टोमा’ में भी इसे प्रयोग में लाकर आशाजनक परिणाम प्राप्त किये गये है।
प्रोटोन किरणपुंज चिकित्सा द्वारा कैंसर के इलाज के क्षेत्र में पूरे विश्व में बहुत सारे प्रयोग किये जा रहे है। प्रोटोन किरणपुंज प्रणाली को स्थापित करने में काफी अधिक स्थान की आवश्यकता होती है तथा प्रोटोन त्वरक को लगाना बहुत खर्चीला भी होता है। परंतु, इस तकनीक के लाभों को देखते हुए विश्व के विभिन्न देशों में इस तकनीक का प्रयोग किया जा रहा है। भारत में भी मुंबई एवं चेन्नई महानगरों में 2 प्रोटोन चिकित्सा प्रणालियां स्थापित किये जाने की योजना बनाई गई है तथा कैंसर चिकित्सा समुदाय द्वारा इसे भविष्य में कैंसर चिकित्सा की सक्षम सुविधा एवं आधुनिकतम प्रणालियों में से एक के रूप में आशाभरी नजरों से देखा जा रहा है। (साभार : वैज्ञानिक)
संजय कुमार सक्सेना
कैंसर के उपचार में प्रोटोन चिकित्सा की भूमिका